品質試験は、再生医療を安全に実施するために必須の試験項目です。
H.U.セルズは、H.U.グループである株式会社エスアールエルにて、バイオ医薬品(バイオテクノロジー応用医薬品/生物起源・由来医薬品)・再生医療等製品を対象に、生物学的な手法によりICHQ5A、Q5D、等で要求されている試験を日本薬局方に準拠して実施します。
◎当社では、試験目的/委託者様の要望に応じて「1.薬機法施行規則 第43条に規定する申請資料の信頼性基準を満たす試験」「2.それ以外の試験」で試験を実施しております。
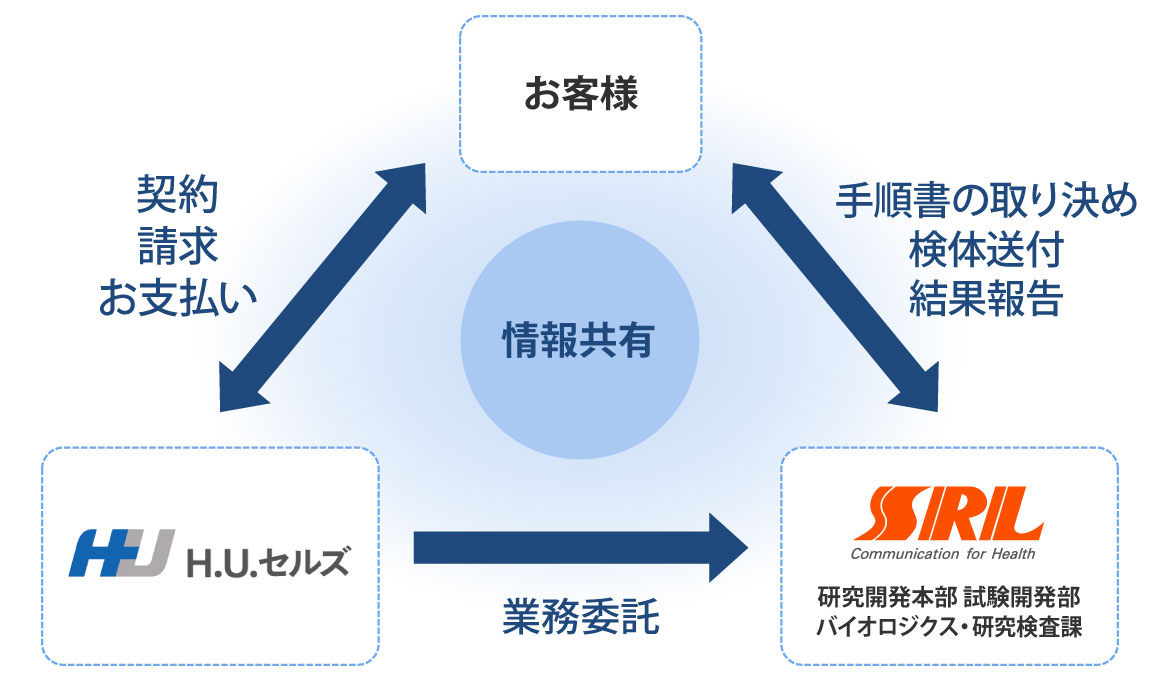
品質試験 実施体制
H.U.セルズが窓口となり、エスアールエル品質試験担当者との試験内容に関する御打ち合わせを調整。その後の御見積、契約等を対応致します。
品質試験の実施は、エスアールエル バイオロジクス研究検査課がお客様とタイムリーなコミュニケーションを築き、高品質な試験を実施致します。
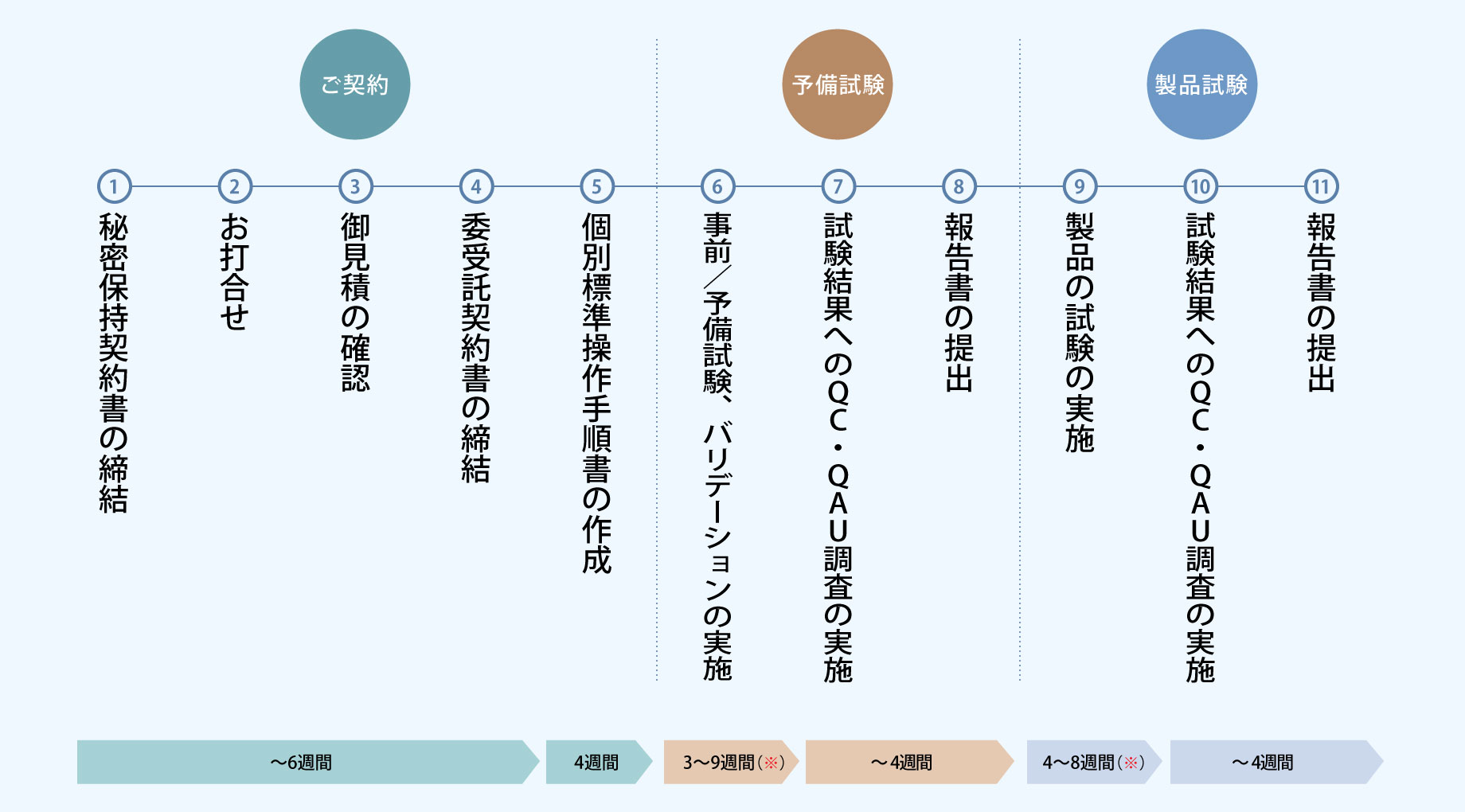
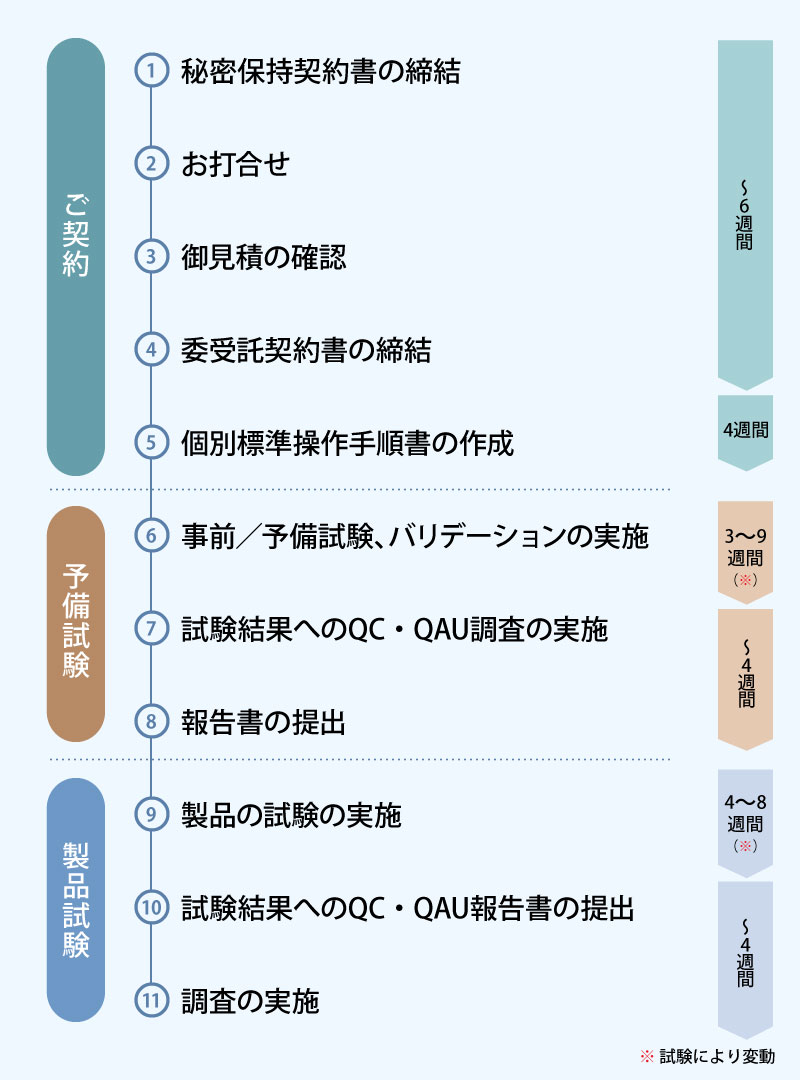
検査の流れ
上記の流れ、期間は一例です。お客様の開発状況、ご依頼される試験の位置付け等によって異なってまいります。
各試験実施前には試験毎に標準操作手順書(測定SOP)を作成致します。内容に要する時間によって期間が変動致します。
弊社では、日本薬局方に準じて、予備試験(バリデーション試験)を実施の後、製品の試験を実施致します。
エンドトキシン試験法Bacterial Endotoxins Test


エンドトキシンがライセート試液中に含まれる因子を増幅活性し、一連の反応によるゲル化、濁度増加、合成基質の切断による黄色発色を測定し、エンドトキシン量を判定します。
弊社で実施している試験法は、光学的定量法の比濁法になります。
エンドトキシン試験法
※1 バックアップを含みます
※2 検体受領から成績書発行までの期間です。事前に委受託契約締結、手順書作成が必要です。
※3 反応干渉因子試験により決定
反応干渉因子試験
提供された測定検体に、試験時の反応を干渉(反応促進、または阻害)する因子の有無を事前に確認いたします。
弊社では、原則、(新規の検体については)反応干渉因子試験実施後に、検体のエンドトキシン試験を実施致します。
無菌試験Sterility test


弊社で受託する無菌試験は、培養法によって増殖しうる微生物(細菌又は真菌)の有無を試験する方法であり、日本薬局方に準じた以下の試験法となります。
-
直接法
-
メンブランフィルター法(MF法)
※培地性能試験:本試験で用いる培地は、事前に社内で検定を行い、無菌性及び培地性能性試験に適合した培地を使用いたします。
無菌試験
※1 Yについては、製造スケール・規格等により決まります(バックアップを含みます)
※2 検体受領から成績書発行までの期間です。事前に委受託契約締結、手順書作成が必要です。
手法の適合性試験
手法の適合性試験は、無菌試験に先立って、あるいは同時に実施し、提出された検体(供試試料や製品)の抗菌活性の有無を確認する方法です。
手法の適合性試験で検討した方法を用いて無菌試験(製品の無菌試験)を実施します。
無菌試験に供する検体量
無菌試験に供する最終製品の個数は「ロットあたりの製造個数」によって規定されています。
同時に製品の「容器あたりの内容量」によって各培地あたりの最少試料採取量が規程されます。
これら2つの要件から無菌試験に使用する製品の量を決定いたします。
日本薬局方に記された「各培地あたりの最少試料採取量」ならびに「最少供試個数」の表を以下に記します。
各培地あたりの最少試料採取量
| 製品 | 容器の内容量 | 他に規定されていない限り それぞれの培地に接種する最少量 |
|---|---|---|
| 液剤 | 1mL未満 | 全量 |
| 1mL以上 40mL以下 | 半量, ただし1mL以上 | |
| 40mL 超100mL以下 | 20mL | |
| 100mL超 | 10%, ただし20mL以上 | |
| 抗生物質の液剤 | 1mL | |
| 懸濁または乳化して用いる非水溶性医薬品、クリームまたは軟膏剤 | 200mg以上 | |
| 固形剤 | 50mg未満 | 全量 |
| 50mg以上300mg未満 | 半量, ただし50mg以上 | |
| 300mg以上5g以下 | 150mg | |
| 5g超 | 500mg |
| 容器の内容量 | 他に規定されていない限り それぞれの培地に接種する最少量 |
|---|---|
| 液剤 | |
| 1mL未満 | 全量 |
| 1mL以上 40mL以下 | 半量, ただし1mL以上 |
| 40mL 超100mL以下 | 20mL |
| 100mL超 | 10%, ただし20mL以上 |
| 抗生物質の液剤 | 1mL |
| 懸濁または乳化して用いる非水溶性医薬品、 クリームまたは軟膏剤 |
|
| 200mg以上 | |
| 固形剤 | |
| 50mg未満 | 全量 |
| 50mg以上300mg未満 | 半量, ただし50mg以上 |
| 300mg以上5g以下 | 150mg |
| 5g超 | 500mg |
ロットあたりの最少抜取個数(最少供試個数)
| 製品 | ロットあたりの製造個数(※1) | 他に規定されていない限り それぞれの培地あたりの最少試験個数(※2) |
|---|---|---|
| 注射剤 | 100容器以下 | 10%または4容器のうち多いほう |
| 101容器以上500容器以下 | 10容器 | |
| 501容器以上 | 2%または20容器 (表示量が100mL以上の製剤の場合は、10容器) のうち少ないほう |
|
| 眼軟膏剤および 点眼剤等の非注射剤(※3) |
200容器以下 | 5%または2容器のうち多いほう |
| 201容器以上 | 10容器 | |
| 固形バルク製品 | 4容器以下 | 各容器 |
| 5容器以上50容器以下 | 20%または4容器のうち多いほう | |
| 51容器以上 | 2%または10容器のうち多いほう |
| ロットあたりの 製造個数(※1) |
他に規定されていない限り それぞれの培地あたりの 最少試験個数(※2) |
|---|---|
| 注射剤 | |
| 100容器以下 | 10%または4容器のうち多いほう |
| 101容器以上 500容器以下 |
10容器 |
| 501容器以上 | 2%または20容器 (表示量が100mL以上の製剤の場合は、10容器) のうち少ないほう |
| 眼軟膏剤および点眼剤等の非注射剤(※3) | |
| 200容器以下 | 5%または2容器のうち多いほう |
| 201容器以上 | 10容器 |
| 固形バルク製品 | |
| 4容器以下 | 各容器 |
| 5容器以上50容器以下 | 20%または4容器のうち多いほう |
| 51容器以上 | 2%または10容器のうち多いほう |
※1 ロットあたりの製造個数が不明の場合には、本欄に示した最大数を用いること。
※2 1容器の内容量が2つの培地に接種するのに十分な場合は、本欄は両培地合わせて必要な供試容器数を示す。
※3 単回使用製品の場合は、上欄の注射剤についての規定を適用する。
マイコプラズマ否定試験Mycoplasma Testing


弊社では、以下の3試験を受託することが可能です。日本薬局方参考情報の試験法に準じて試験を実施いたします。
-
培養法
-
指標細胞を用いたDNA染色法
-
核酸増幅法
(Nucleic acids amplification test:NAT)
マイコプラズマ否定試験
※1 バックアップを含みます
※2 検体受領から成績書発行までの期間です。事前に委受託契約締結、手順書作成が必要です。
マイコプラズマ発育阻止因子の試験

日本薬局方には、「被検細胞の培養液中に抗生物質などのマイコプラズマ発育阻止因子が含まれているような場合には発育阻止因子を除去する必要がある」と記載があります。
「培養法」の試験実施前には原則当該試験を実施いたします。
マイコプラズマ否定試験(NAT)の分析法バリデーション
分析バリデーションにて、検出感度、特異性について評価します。
検出感度
NATの検出感度の評価では、細胞懸濁液中に、菌濃度(CFU値等) が明らかなマイコプラズマ7菌種をスパイクし評価いたします。
スパイクするウイルスを適切な希釈列(例えば、10倍希釈または100.5倍希釈など)(最低3つの異なる希釈列)を作製し、異なる日に複数回の測定を行います。主となる希釈列は合計24回の繰り返し数となるように測定を実施いたします。
使用する菌種
日本薬局方に記された下記の7菌種を用いて実証いたします。
- ・Acholeplasma laidlawii
- ・Mycoplasma arginini
- ・Mycoplasma fermentans
- ・Mycoplasma hyorhinis
- ・Mycoplasma orale
- ・Mycoplasma pneumoniae
- ・Mycoplasma salivarium
★NATの分析バリデーションの必要性について
多くの市販キットはすでに製造業者によって十分なバリデーション試験が実施され、妥当性が検証済とされています。しかし、試験対象となる細胞の種類や細胞数、試験に用いられる検体量が異なると、核酸の抽出効率や検出感度が変わり、十分な検出感度が得られない場合がございます。
弊社では、供試検体の検出感度を確認した上で、本試験の結果をご報告しております。(日本薬局方でもバリデーションを求められております)
ウィルス否定試験(NAT)Virus Testing


供試試料中に存在する以下のウイルスについて、核酸増幅法(NAT)にて確認致します。
確認ウイルス種:HBV, HCV, HIV-1, HTLV-1, B19V, CMV, EBV, WNV
※上記8種以外のご確認を希望される場合はご相談下さい
ウィルス否定試験(NAT)
※1 Xについては、製造スケール・規格等により決まります(バックアップを含みます)
※2 検体受領から成績書発行までの期間です。事前に委受託契約締結、手順書作成が必要です。
バリデーション試験
分析バリデーションにて、検出感度、特異性について評価します。
検出感度
NATの検出感度の評価では、細胞懸濁液中に、各ウイルス(※)をスパイクし評価いたします。
スパイクするウイルスを適切な希釈列(例えば、10倍希釈または100.5倍希釈など)(最低3つの異なる希釈列)を作製し、異なる日に複数回の測定を行います。主となる希釈列は合計24回の繰り返し数となるように測定を実施いたします。
※HTLV-1についてはプロウイルス
in vitro ウイルス試験in vitro Virus test


外来性ウイルスを指標細胞(Vero細胞、MRC-5細胞、CHO細胞、等)を用いて検出致します。
in vitro ウイルス試験
予備試験
・3種の細胞について毒性試験を実施致します。
・3種のウイルスについて干渉試験を実施致します。
・判定はCPE(細胞変性)で行います。
本試験
・判定はCPE(細胞変性)、HAd(血球吸着)で行います。
in vivo ウイルス試験in vivo Virus test
成熟マウス、乳のみマウス、発育鶏卵に検体を接種し、発症率、死亡率を確認し、外来性ウイルスを検出致します。
※本試験は、弊社が提携する外部機関への再委託にて実施いたします
抗体産生試験Antibody production test
マウス(MAP)、ハムスター(HAP)、ラット(RAP)へ検体を接種し、臨床的兆候の観察と、接種された動物の血清に含まれる抗体を確認することで、ウイルスを検出致します。
※本試験は、弊社が提携する外部機関への再委託にて実施いたします
その他外来性ウイルス試験other Virus test
ウシ由来ウイルス(BT細胞/Vero細胞)、ブタ由来ウイルス(PPK細胞)を用いたウイルス検出試験を致します。
※本試験は、弊社が提携する外部機関への再委託にて実施いたします